金屬防銹劑背后的電池反應(yīng)秘密
大家好,今天我們來(lái)聊聊金屬防銹劑和電池反應(yīng)之間的有趣關(guān)系。金屬防銹劑的存在其實(shí)是因?yàn)樽匀唤缰械碾姵胤磻?yīng),這聽(tīng)起來(lái)有點(diǎn)神奇吧?讓我來(lái)給你們?cè)敿?xì)解釋一下。
原電池的構(gòu)成條件
1.活潑性不同的兩個(gè)電極。
2.電解質(zhì)溶液,一般能與較活潑金屬自發(fā)地進(jìn)行氧化還原反應(yīng)。
3.形成閉合回路。
1、概念及反應(yīng)本質(zhì)
把化學(xué)能轉(zhuǎn)化為電能的裝置,其本質(zhì)是發(fā)生了氧化還原反應(yīng)。
2、構(gòu)成條件
(1)有兩個(gè)活動(dòng)性不同的電極(常見(jiàn)為金屬或石墨)。
(2)將電極插入電解質(zhì)溶液中。
(3)兩電極間構(gòu)成閉合回路(兩電極接觸或用導(dǎo)線連接)。
(4)能自發(fā)發(fā)生氧化還原反應(yīng)。
歸納總結(jié)
1、原電池的工作原理簡(jiǎn)圖
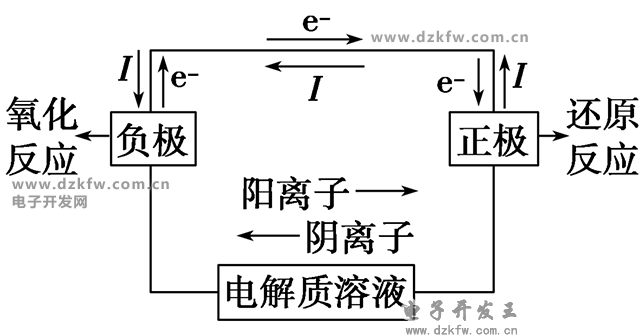
注意:
①一般負(fù)極金屬較活潑,正極金屬或非金屬不活潑。
②一般負(fù)極溶解或質(zhì)量減輕,正極有氣泡或質(zhì)量增重。
③若有鹽橋,鹽橋中的陰離子移向負(fù)極區(qū),陽(yáng)離子移向正極區(qū)。
鐵生銹的化學(xué)原理 🌿
在中學(xué)時(shí)代,我們學(xué)過(guò)鐵生銹的化學(xué)方程式:鐵 + 氧氣 = 四氧化三鐵(或三氧化二鐵)。這個(gè)反應(yīng)其實(shí)是因?yàn)殍F的活性較大,容易和氧氣發(fā)生化學(xué)反應(yīng),生成鐵銹。雖然這個(gè)解釋很簡(jiǎn)單,但它確實(shí)說(shuō)明了鐵在空氣中會(huì)生銹。
電池反應(yīng)的復(fù)雜性 🔋
到了高中,我們接觸到了電化學(xué)反應(yīng),也就是電池反應(yīng)。這時(shí)候老師會(huì)告訴我們,鐵在空氣中并不是直接和氧氣反應(yīng),而是和水一起參與了一個(gè)復(fù)雜的電池反應(yīng)。簡(jiǎn)單來(lái)說(shuō),我們把鐵作為原電池的負(fù)極,鐵表面的氧氣作為正極,在水作為電解質(zhì)的情況下,鐵很快失去電子,形成亞鐵和鐵離子,而正極氧氣得到電子成為負(fù)二價(jià),并與鐵形成氧化鐵。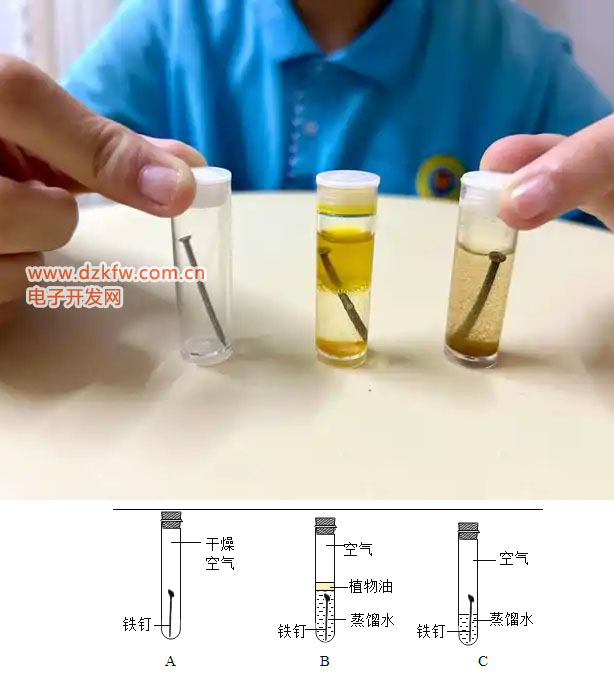
水的角色 💧
這個(gè)反應(yīng)中,水的參與是關(guān)鍵。因?yàn)樵陔娊赓|(zhì)中需要陰離子的存在,負(fù)二價(jià)的陽(yáng)離子是無(wú)法在電解質(zhì)中存在的,通常是快速與水合并形成負(fù)一價(jià)的氫氧根離子,先與鐵形成氫氧化鐵。而氫氧化鐵會(huì)進(jìn)一步與水和氧氣發(fā)生反應(yīng)生成氧化鐵。如果產(chǎn)生氫氧化亞鐵,將繼續(xù)電池反應(yīng),直到穩(wěn)定為三氧化二鐵。
電子的流向
雖然這個(gè)反應(yīng)非常復(fù)雜,說(shuō)不清楚正極和負(fù)極到底在哪里,也說(shuō)不清楚電子的流向,但這個(gè)過(guò)程隨時(shí)會(huì)發(fā)生,天天在運(yùn)行。要不是這樣,鐵不會(huì)輕易生銹,也用不著金屬除銹劑。
防銹劑的必要性
氧化還原反應(yīng)就是這樣,不需要外界提供熱量,反而會(huì)放出熱量。從電化學(xué)的角度來(lái)說(shuō),是電動(dòng)勢(shì)大于0,呆不住。總之,鐵、水、氧氣放在一起就是不老實(shí),不放點(diǎn)熱量出來(lái),穩(wěn)定不了,鐵銹就這樣輕易地產(chǎn)生了。
結(jié)語(yǔ) 🌟
因此,再評(píng)價(jià)鐵的原電池的電池反應(yīng)就是個(gè)無(wú)解的問(wèn)題。似乎也不存在沒(méi)有空氣和水蒸氣的環(huán)境來(lái)使用金屬,即使存在也只是相對(duì)的。含氧氣和水分的多與少。引用一個(gè)朋友的話說(shuō),世界上還真是不存在任何一種物質(zhì),放在那里不管它,不會(huì)往壞掉或者不好的方向發(fā)展,只有人類就是不斷的開(kāi)發(fā)一些“逆商”的產(chǎn)物,鐵會(huì)生銹,就開(kāi)發(fā)金屬除銹劑和防銹劑之類的產(chǎn)品來(lái)解決它。
以上就是今天的分享,希望對(duì)大家有所幫助!


 返回頂部
返回頂部 刷新頁(yè)面
刷新頁(yè)面 下到頁(yè)底
下到頁(yè)底