ФӯлҠіШөДҳӢ(gЁ°u)іЙ—lјю
1.»оқҠРФІ»Н¬өДғЙӮҖ(gЁЁ)лҠҳOЎЈ
2.лҠҪвЩ|(zhЁ¬)ИЬТәЈ¬Т»°гДЬЕcЭ^»оқҠҪрҢЩЧФ°l(fЁЎ)өШЯM(jЁ¬n)РРСх»ҜЯҖФӯ·ҙ‘Ә(yЁ©ng)ЎЈ
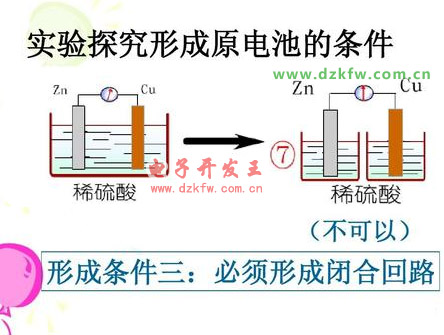
3.РОіЙй]әП»ШВ·ЎЈ
ФӯлҠіШФӯАнөД‘Ә(yЁ©ng)УГЈә
(1)ёщ“ю(jЁҙ)РОіЙФӯлҠіШЕР”аҪрҢЩөД»о„У(dЁ°ng)РФёщ“ю(jЁҙ)»оқҠҪрҢЩһйШ“(fЁҙ)ҳOЈ¬І»»оқҠҪрҢЩһйХэҳOЈ¬ҝЙНЁЯ^(guЁ°)ҪMіЙФӯлҠіШЕР”аҪрҢЩ»о„У(dЁ°ng)РФЎЈ
(2)РОіЙФӯлҠіШҝЙТФјУҝм·ҙ‘Ә(yЁ©ng)ЛЩВКјғд\ЕcПЎH2SO4·ҙ‘Ә(yЁ©ng)ЛЩВКЭ^ВэЈ¬®”(dЁЎng)јУИлCuSO4ИЬТәТФәуЈ¬·ҙ‘Ә(yЁ©ng)ЛЩВКјУҝмЈ¬Тт?yЁӨn)йZn+Cu2+=Cu+Zn2+ОціцөДCuЕcZnҪУУ|Ј¬ФЪПЎH2SO4ЦРРОіЙФӯлҠіШЈ¬јУҝм·ҙ‘Ә(yЁ©ng)ЛЩВКЎЈ
(3)ёщ“ю(jЁҙ)ФӯлҠіШФӯАнҝЙТФЕР”алҠіШөДХэШ“(fЁҙ)ҳOЎўлҠҪвЩ|(zhЁ¬)ИЬТәЎўЕР”аИЬТәpHөДЧғ»Ҝ
(4)ёщ“ю(jЁҙ)ФӯлҠіШФӯАнҝЙТФұЈЧo(hЁҙ)ҪрҢЩІ»ұ»ёҜОg
(5)ЕР”аҪрҢЩёҜОgіМ¶ИөДҝмВэ
ФӯлҠіШЦРы}ҳтөДЧчУГ:
ы}ҳтЦРөДы}ИЬТәКЗлҠҪвЩ|(zhЁ¬)ИЬТә(НЁіЈСbУРә¬ӯӮДzөДKClп–әНИЬТә)Ј¬ДЬК№ғЙҹэұӯЦРөДИЬТәЯBіЙТ»ӮҖ(gЁЁ)НЁВ·ЎЈНЁЯ^(guЁ°)ы}ҳтЦРкҺЎўк–(yЁўng)лxЧУөД¶ЁПтТЖ„У(dЁ°ng)(к–(yЁўng)лxЧУТЖПтХэҳOЈ¬кҺлxЧУТЖПтШ“(fЁҙ)ҳO)ҫSіЦғЙӮҖ(gЁЁ)°ллҠіШөДлҠЦРРФЈ¬ТФК№ФӯлҠіШЯBАm(xЁҙ)№ӨЧчЎЈы}ҳт?qЁұ)ўСх»ҜЯҖФӯ·ҙ‘Ә(yЁ©ng)өДғЙӮҖ(gЁЁ)°л·ҙ‘Ә(yЁ©ng)ёфй_(kЁЎi)ЯM(jЁ¬n)РРЈ¬ДЬМбёЯФӯлҠіШөД№ӨЧчР§ВКЈ¬ңpҫҸлҠБчЛҘңpЎЈ
ФӯлҠіШФӯАнөД‘Ә(yЁ©ng)УГЈә
ұИЭ^І»Н¬ҪрҢЩөД»о„У(dЁ°ng)РФҸҠ(qiЁўng)Их
ёщ“ю(jЁҙ)ФӯлҠіШФӯАнҝЙЦӘЈ¬ФЪФӯлҠіШ·ҙ‘Ә(yЁ©ng)Я^(guЁ°)іМЦРЈ¬Т»°г»о„У(dЁ°ng)РФҸҠ(qiЁўng)өДҪрҢЩЧчШ“(fЁҙ)ҳOЈ¬¶ш»о„У(dЁ°ng)РФИхөДҪрҢЩ(»тДЬҢ§(dЁЈo)лҠөД·ЗҪрҢЩ)ЧчХэҳOЎЈ
ИфУРғЙ·NҪрҢЩAәНBЈ¬УГҢ§(dЁЈo)ҫҖҢўAәНBЯBҪУәуЈ¬ІеИлөҪПЎБтЛбЦРЈ¬Т»¶О•r(shЁӘ)йgәуЈ¬ИфУ^ІмөҪAҳOИЬҪвЈ¬¶шB(niЁЈo) ҳOЙПУРҡвуw·ЕіцЈ¬Хf(shuЁӯ)ГчФЪФӯлҠіШ№ӨЧчЯ^(guЁ°)іМЦРЈ¬Aұ»Сх»ҜіЙк–(yЁўng)лxЧУ¶шК§ИҘлҠЧУЧчШ“(fЁҙ)ҳOЈ¬BЧчХэҳOЈ¬„tҪрҢЩAөДҪрҢЩ»о„У(dЁ°ng)РФұИBҸҠ(qiЁўng)ЎЈ
јУҝмСх»ҜЯҖФӯ·ҙ‘Ә(yЁ©ng)өДЛЩВК
Тт?yЁӨn)йРОіЙФӯлҠіШә󣬮a(chЁЈn)ЙълҠО»ІоЈ¬К№лҠЧУөДЯ\(yЁҙn)„У(dЁ°ng)ЛЩВКјУҝмЈ¬ҸД¶шК№·ҙ‘Ә(yЁ©ng)ЛЩВКФцҙуЈ¬ИзZnЕcПЎH2SO4·ҙ‘Ә(yЁ©ng)ЦЖСхҡв•r(shЁӘ)Ј¬ҝЙПтИЬТәЦРөОјУЙЩБҝCuSO4ИЬТәЈ¬РОіЙCuЎӘZnФӯлҠіШЈ¬јУҝм·ҙ‘Ә(yЁ©ng)ЛЩВК 3Ј®УГУЪҪрҢЩөД·АЧo(hЁҙ)ТӘұЈЧo(hЁҙ)Т»ӮҖ(gЁЁ)иFЦЖйlйT(mЁҰn)Ј¬ҝЙУГҢ§(dЁЈo)ҫҖҢўЖдЕcТ»д\үKПаЯBЈ¬К№д\ЧчФӯлҠіШөДШ“(fЁҙ)ҳOЈ¬иFЦЖйlйT(mЁҰn)ЧчХэҳOЎЈ
ФO(shЁЁ)УӢ(jЁ¬)ЦЖЧч»ҜҢW(xuЁҰ)лҠФҙФO(shЁЁ)УӢ(jЁ¬)ФӯлҠіШ•r(shЁӘ)ТӘҫoҝЫҳӢ(gЁ°u)іЙФӯлҠіШөД—lјюЎЈ
КЧПИТӘҢўТСЦӘСх»ҜЯҖФӯ·ҙ‘Ә(yЁ©ng)Ір·ЦһйғЙӮҖ(gЁЁ)°л·ҙ‘Ә(yЁ©ng)Јә
И»әуёщ“ю(jЁҙ)ФӯлҠіШөДлҠҳO·ҙ‘Ә(yЁ©ng)МШьc(diЁЈn)Ј¬ҪY(jiЁҰ)әПғЙӮҖ(gЁЁ)°л·ҙ‘Ә(yЁ©ng)ХТіцХэЎўШ“(fЁҙ)ҳOІДБП(Т»°гШ“(fЁҙ)ҳOҫНКЗК§лҠЧУөДОпЩ|(zhЁ¬)Ј¬ХэҳOУГұИШ“(fЁҙ)ҳO»оқҠРФІоөДҪрҢЩ»т?qЁұ)§лҠөД·ЗҪрҢ?ј°лҠҪвЩ|(zhЁ¬)ИЬТәЈә
ўЩлҠҪвЩ|(zhЁ¬)ИЬТәөДЯx“слҠҪвЩ|(zhЁ¬)ИЬТәТ»°гТӘДЬүтЕcШ“(fЁҙ)ҳO°l(fЁЎ)Йъ·ҙ‘Ә(yЁ©ng)Ј¬»тХЯДЬЕcлҠҳO®a(chЁЈn)Оп°l(fЁЎ)Йъ·ҙ‘Ә(yЁ©ng)ЎЈө«Из№ығЙӮҖ(gЁЁ)°л·ҙ‘Ә(yЁ©ng)·Ц„eФЪғЙӮҖ(gЁЁ)ИЭЖчЦРЯM(jЁ¬n)РР(ЦРйgЯBҪУы}ҳт)Ј¬ЧуУТғЙӮҖ(gЁЁ)ИЭЖчЦРөДлҠҪвЩ|(zhЁ¬)ИЬТә‘Ә(yЁ©ng)Яx“сЕcлҠҳOІДБППаН¬өДк–(yЁўng)лxЧУЎЈИзФЪг~Т»д\Т»БтЛбг~ҳӢ(gЁ°u)іЙөДФӯлҠіШЦРЈ¬Ш“(fЁҙ)ҳOҪрҢЩд\ҪюЕЭФЪә¬УР Zn2+Ў°өДлҠҪвЩ|(zhЁ¬)ИЬТәЦРЈ¬¶шХэҳOг~ҪюЕЭФЪә¬УРCu2+өДИЬТәЦРЈ®
ўЪлҠҳOІДБПөДЯx“сФЪФӯлҠіШЦРЈ¬Яx“сЭ^»оқҠөДҪрҢЩ»тЯҖФӯРФЭ^ҸҠ(qiЁўng)өДОпЩ|(zhЁ¬)ЧчһйШ“(fЁҙ)ҳOЈ¬Э^І»»оқҠөДҪрҢЩ»тДЬҢ§(dЁЈo)лҠөД·ЗҪрҢЩ»тСх»ҜРФЭ^ҸҠ(qiЁўng)өДОпЩ|(zhЁ¬)ЧчһйХэҳOЎЈТ»°гЈ¬ФӯлҠіШөДШ“(fЁҙ)ҳOДЬүтЕcлҠҪвЩ|(zhЁ¬)ИЬТә·ҙ‘Ә(yЁ©ng)Ј¬ИЭТЧК§ИҘлҠЧУЈ¬ТтҙЛШ“(fЁҙ)ҳOТ»°гКЗ»оқҠөДҪрҢЩІДБП(ТІҝЙТФКЗЯҖФӯРФЭ^ҸҠ(qiЁўng)өД·ЗҪрҢЩІДБПИзH2ЎўCH4өИ)ЎЈ
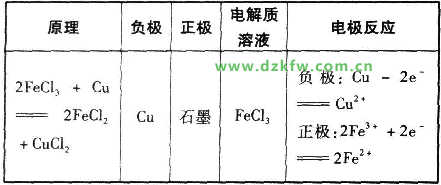
ЕeАэёщ“ю(jЁҙ)ТФПВ·ҙ‘Ә(yЁ©ng)ФO(shЁЁ)УӢ(jЁ¬)ФӯлҠіШЈә


 ·ө»Шн”Іҝ
·ө»Шн”Іҝ ЛўРВн“(yЁЁ)Гж
ЛўРВн“(yЁЁ)Гж ПВөҪн“(yЁЁ)өЧ
ПВөҪн“(yЁЁ)өЧ