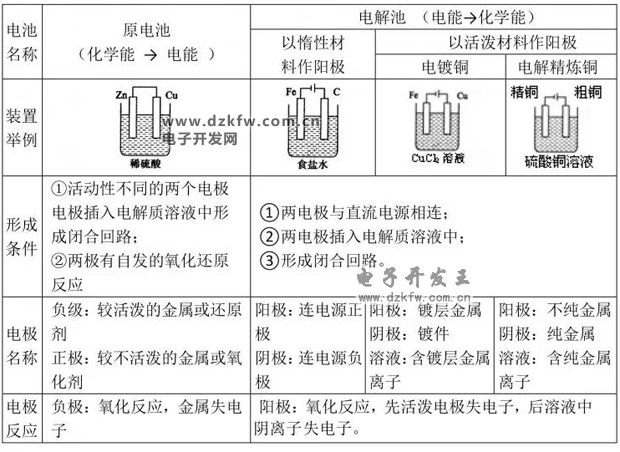
電解池陰陽極判斷
電解池是電能轉化為化學能的裝置,從定義來看,連接電源正極的是陽極,連接電源負極的是陰極。
從另外一些方面來判斷:
1、電極表面失電子的是陽極,得電子的是陰極
2、吸引陰離子的是陽極,吸引陽離子的是陰極
3、發生氧化反應的是陽極,發生還原反應的是陰極
4、電極表面有金屬析出的是陰極
5、電極溶解的是陽極(Ag以前金屬)。
電極反應式的書寫:
1.根據裝置書寫電極反應式
(1)根據電源確定陰、陽兩極→確定陽極是否是活性電極→據電極類型及電解質溶液中陰、陽離子的放電順序寫出電極反應式。
(2)在確保陰、陽兩極轉移電子數目相同的條件下,將兩極電極反應式合并即得總反應式。
2.由氧化還原反應方程式書寫電極反應式
(1)找出發生氧化反應和還原反應的物質→確定兩極名稱和生成物→利用電子守恒分別寫出兩極反應式。
(2)若寫出一極反應式,而另一極反應式不好寫,可用總反應式減去已寫出的電極反應式,即得另一電極反應式。
電解池陰陽極判斷
電解池是電能轉化為化學能的裝置,從定義來看,連接電源正極的是陽極,連接電源負極的是陰極。
基本概念
1、使電流通過電解質溶液或熔融的電解質而在陰、陽兩極上引起還原氧化反應的過程叫做電解。
2、把電能轉變為化學能的裝置叫做電解池或電解槽。
3、當離子到達電極時,失去或獲得電子,發生氧化還原反應的過程電解原理。
陰極:與電源負極相連的電極。(得電子發生還原反應)
陽極:與電源正極相連的電極。(失電子發生氧化反應)


 返回頂部
返回頂部 刷新頁面
刷新頁面 下到頁底
下到頁底