蓄電池通常用硫酸密度來衡量電解液的濃度。 充足電,密度1.26~1.28g/cm^3,相當(dāng)于濃度是35~38% 完全放電:密度1.10~1.15,相當(dāng)于濃度10~15% 充足電的電池,硫酸密度與稀硫酸原液濃度是一致的,因此把電解液倒出,再加上稀硫酸原液。
電瓶一般是鉛酸蓄電池,它正常使用時(shí),要求硫酸濃度,比重為1.27-1.28之間。使用過程中,不能虧電,否則兩極板之間會(huì)生成硫酸鉛結(jié)晶,它在于后的再充電過程就不能去除,成為死角。虧電時(shí)間久,生成的硫酸鉛結(jié)晶多,電瓶就沒用了。就不存電了。
鉛酸蓄電池基本原理
鉛酸蓄電池由若干對(duì)正、負(fù)極板相互交疊形成極群。
活性物質(zhì)的量(由極板面積、厚度、極板對(duì)數(shù)量等因素決定)決定了貯存容量和電池容量。
此外,電池運(yùn)行還顯著的決定于“活性物質(zhì)的有效活性表面”,因此,活性物質(zhì)的孔隙率應(yīng)經(jīng)常考慮。
“accumulator”,來自拉丁語,表示“蓄電池”或“貯能蓄電池”。后面的意思經(jīng)常使用。
通過化學(xué)和電化學(xué)反應(yīng),電池貯存能量。即,通過電化學(xué)過程產(chǎn)生電能,反之亦然。
放電時(shí):貯存的化學(xué)能轉(zhuǎn)變成電能。
充電時(shí):將電能以化學(xué)能的形式貯存起來。
鉛酸蓄電池屬于二次電池。(不同于原電池只能用于放電,不能充電)
電子:
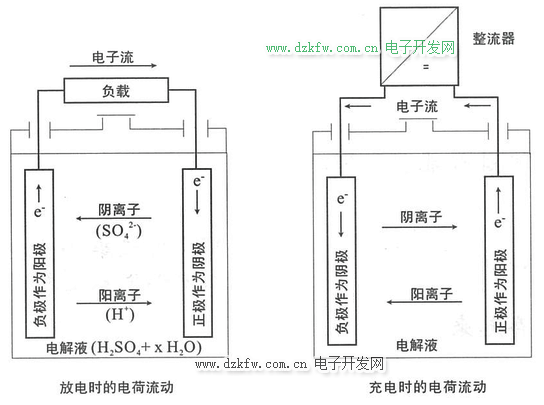
放電時(shí),當(dāng)負(fù)載接通形成電流時(shí),電子從負(fù)極(經(jīng)負(fù)載)流向正極。
充電時(shí),電子通過負(fù)極端子提供給電池。
在文獻(xiàn)中往往剪刀相反的說法,即,放電時(shí),電池外部的電流從正極流向負(fù)極,而充電時(shí)從負(fù)極流向正極。這個(gè)方向正好與電子流動(dòng)的方向相反,被稱為“工程上的電流方向”。按照作者的觀點(diǎn),電子流動(dòng)的方向是“電流的實(shí)際方向”。這是本篇文章所描述過程的基礎(chǔ),兩者不能混淆。
電子是帶負(fù)電的質(zhì)點(diǎn)。根據(jù)放電時(shí)從哪里提供電子,和充電時(shí)從哪里接受電子,最后規(guī)定電池端子(和極板)的稱謂和標(biāo)記。
標(biāo)記“-”(或“Neg”或“N”)為負(fù)極端子,連接負(fù)極板(Negatives)。
標(biāo)記“+”(或“Pos”或“P”)為正極端子,連接正極板(Positives)。


 返回頂部
返回頂部 刷新頁面
刷新頁面 下到頁底
下到頁底