1、概念及反應本質
把化學能轉化為電能的裝置,其本質是發生了氧化還原反應。
2、構成條件
(1)有兩個活動性不同的電極(常見為金屬或石墨)。
(2)將電極插入電解質溶液中。
(3)兩電極間構成閉合回路(兩電極接觸或用導線連接)。
(4)能自發發生氧化還原反應。
3、工作原理
如圖是Cu--Zn原電池
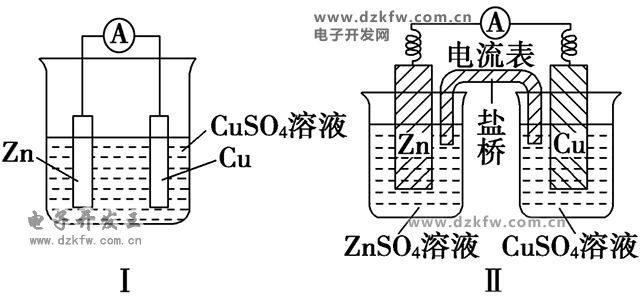
(1)反應原理
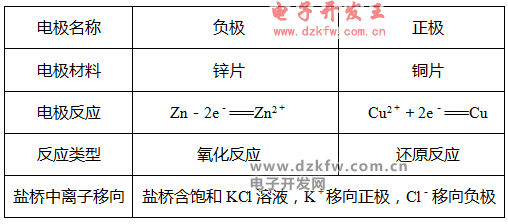
(2)原電池中的三個方向
①電子方向:從負極流出沿導線流入正極;
②電流方向:從正極沿導線流向負極;
③離子的遷移方向:電解質溶液中,陰離子向負極遷移,陽離子向正極遷移。
(3)兩種裝置的比較
圖Ⅰ中Zn在CuSO4溶液中直接接觸Cu2+,會有一部分Zn與Cu2+直接反應,該裝置中既有化學能和電能的轉化,又有一部分化學能轉化成了熱能,裝置的溫度會升高。
圖Ⅱ中Zn和CuSO4溶液分別在兩個池中,Zn與Cu2+不直接接觸,不存在Zn與Cu2+直接反應的過程,所以僅是化學能轉化成了電能,電流穩定,且持續時間長。
(4)鹽橋作用
①連接內電路,形成閉合回路;
②平衡電荷,使原電池不斷產生電流。
歸納總結
1、原電池的工作原理簡圖
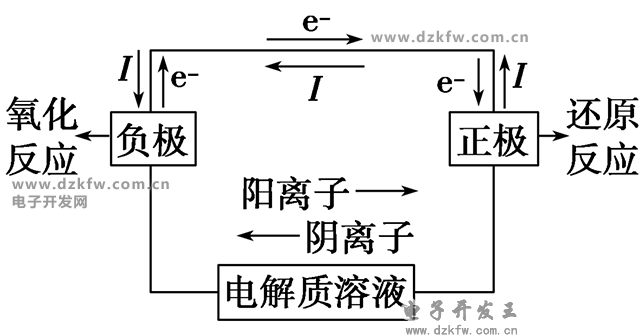
注意:
①一般負極金屬較活潑,正極金屬或非金屬不活潑。
②一般負極溶解或質量減輕,正極有氣泡或質量增重。
③若有鹽橋,鹽橋中的陰離子移向負極區,陽離子移向正極區。
2、原電池的判斷方法
(1)先分析有無外接電源,有外接電源的為電解池,無外接電源的可能為原電池。
(2)然后依據原電池的形成條件判斷裝置是否為原電池,方法如下:

(3)多池相連,但無外接電源時,兩極活潑性差異最大的一池為原電池,其他各池可看做電解池。
3、原電池正、負極判斷的七種方法
(1)由組成原電池的兩極材料判斷。
一般相對較活潑的金屬為負極,相對不活潑的金屬或能導電的非金屬為正極。
(但也有一些并不與活潑性一致,如Mg、Al在酸性介質中,Mg作負極,而在堿性介質中,Al作負極)
(2)根據電流方向或電子流動方向判斷。
在外電路,電流由正極流向負極;電子由負極流向正極。
(3)根據原電池里電解質溶液中離子的定向移動方向判斷。
在原電池的電解質溶液內,陽離子移向正極,陰離子移向負極。
(4)根據原電池兩極發生的變化來判斷。
原電池的負極發生氧化反應,正極發生還原反應。
(5)X極增重或減輕。
工作后,X極質量增加,說明X極有物質析出,X極為正極;反之,X極質量減少,說明X極金屬溶解,X極為負極。
(6)X極有氣體產生。
工作后,X極上有氣體產生,一般若發生了析出H2的電極反應,說明X極為正極。
(7)根據X極附近pH的變化來判斷。
析氫或吸氧的電極反應發生后,均能使該電極附近電解質溶液的pH增大,因而工作后,X極附近pH增大了,說明X極為正極。


 返回頂部
返回頂部 刷新頁面
刷新頁面 下到頁底
下到頁底