電解池原理
(1)電解:使電流通過(guò)電解質(zhì)溶液且在陰、陽(yáng)極兩極引起氧化還原反應(yīng)的過(guò)程叫電解。
(2)裝置:電解池(電解槽)
(3)特點(diǎn):將電能轉(zhuǎn)化為化學(xué)能。
形成條件:①與電源相連的兩個(gè)電極,②電解質(zhì)溶液或熔融電解質(zhì),③形成閉合回路
(4)陰離子放電順序:S2->I->Br->Cl->OH->SO42->NO3->F- 陽(yáng)離子放電順序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)電解時(shí)溶液pH值的變化規(guī)律電解質(zhì)溶液在電解過(guò)程中,有時(shí)溶液pH值會(huì)發(fā)生變化。判斷電解質(zhì)溶液的pH值變化,有時(shí)可以從電解產(chǎn)物上去看。
①若電解時(shí)陰極上產(chǎn)生H2(消耗H+),陽(yáng)極上無(wú)O2產(chǎn)生,電解后溶液pH值增大;
②若陰極上無(wú)H2,陽(yáng)極上產(chǎn)生O2,則電解后溶液pH值減小;
③若陰極上有H2,陽(yáng)極上有O2,且(相當(dāng)于電解水),則有三種情況:
a如果原溶液為中性溶液,則電解后pH值不變;
b如果原溶液是酸溶液,則pH值變小;
c如果原溶液為堿溶液,則pH值變大;
④若陰極上無(wú)H2,陽(yáng)極上無(wú)O2產(chǎn)生,電解后溶液的pH可能也會(huì)發(fā)生變化。如電解CuCl2溶液(CuCl2溶液由于Cu2+水解顯酸性),一旦CuCl2全部電解完,pH值會(huì)變大,成中性溶液。
(6)電解反應(yīng)類(lèi)型:從參加反應(yīng)的物質(zhì)來(lái)分電解反應(yīng)可分成五類(lèi):
①H2O型:實(shí)質(zhì)是電解水。如電解硝酸鈉、氫氧化鈉、硫酸等溶液。
②溶質(zhì)型:溶質(zhì)所電離出來(lái)的離子發(fā)生氧化還原,如電解氯化銅、溴化氫等溶液。
③硫酸銅溶液型:電解產(chǎn)物是金屬、氧氣與酸。如電解硫酸銅溶液生成單質(zhì)銅、氧氣和硫酸,電解硝酸銀溶液時(shí)生成單質(zhì)銀、氧氣和硝酸。
④氯化鈉溶液型:電解產(chǎn)物是非金屬單質(zhì)、氫氣與堿。如電解氯化鈉溶液時(shí)生成氯氣、氫氣和氫氧化鈉,電解溴化鉀溶液時(shí)生成溴單質(zhì)、氫氣和氫氧化鉀。
⑤電鍍型:鍍層金屬作陽(yáng)極,陽(yáng)極反應(yīng)是:M-ne-=Mn+,鍍件作陰極,陰極反應(yīng)是:Mn++ne-=M。(電解精煉與電鍍,實(shí)質(zhì)上是相同的)
電解的其他應(yīng)用
電解的其他應(yīng)用:
(1)電解CuSO4溶液
陰極:Cu2++2e-=Cu
陽(yáng)極:4OH--4e-=O2↑+2H2O
總反應(yīng)式:2Cu2++2H2O2Cu+O2↑+4H+
電解后溶液pH變小,加氧化銅可恢復(fù)原溶液
CuSO4溶液電解的實(shí)質(zhì):電解水和CuSO4
(2)電解Na2SO4溶液
陰極:2H++2e-=H2↑
陽(yáng)極:4OH--4e-=O2↑+2H2O
總反應(yīng)式:2H2O2H2↑+O2↑
Na2SO4溶液電解的實(shí)質(zhì):電解水
電解后溶液PH不變
高中化學(xué)電解池知識(shí)點(diǎn)
電解的原理
電解定義
在電流作用下,電解質(zhì)在兩個(gè)電極上分別發(fā)生氧化反應(yīng)和還原反應(yīng)的過(guò)程。
能量轉(zhuǎn)化形式
電能轉(zhuǎn)化為化學(xué)能。
電解池
構(gòu)成條件
①有與電源相連的兩個(gè)電極。
②電解質(zhì)溶液(或熔融鹽)。
③形成閉合回路。
分析電解過(guò)程的思維程序
首先判斷陰、陽(yáng)極,分析陽(yáng)極材料是惰性電極還是活潑電極。
再分析電解質(zhì)水溶液的組成,找全離子并分陰、陽(yáng)兩組(不要忘記水溶液中的H+和OH-)。
然后排出陰、陽(yáng)兩極的放電順序
陰極:陽(yáng)離子放電順序:
Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
陽(yáng)極:
活潑電極>S2->I->Br->Cl->OH->含氧酸根離子。
分析電極反應(yīng),判斷電極產(chǎn)物,寫(xiě)出電極反應(yīng)式,要注意遵循原子守恒和電荷守恒。
最后寫(xiě)出電解反應(yīng)的總化學(xué)方程式或離子方程式。
電解原理的應(yīng)用
電解飽和食鹽水
電極反應(yīng)
陽(yáng)極反應(yīng)式:2Cl--2e-=Cl2↑(氧化反應(yīng))
陰極反應(yīng)式:2H++2e-=H2↑(還原反應(yīng))
總反應(yīng)方程式
2NaCl+2H2O2NaOH+H2↑+Cl2↑
離子反應(yīng)方程式:2Cl-+2H2O
2OH-+H2↑+Cl2↑
應(yīng)用:氯堿工業(yè)制燒堿、氯氣和氫氣。
電鍍
以金屬表面鍍銀為例,
鍍件作陰極,鍍層金屬銀作陽(yáng)極。
電解質(zhì)溶液是AgNO3溶液等含鍍層金屬陽(yáng)離子的鹽溶液。
電極反應(yīng):
陽(yáng)極:Ag-e-=Ag+;
陰極:Ag++e-=Ag。
特點(diǎn):陽(yáng)極溶解,陰極沉積,電鍍液的濃度不變。
電解精煉銅
電極材料:陽(yáng)極為粗銅;陰極為純銅。
電解質(zhì)溶液:含Cu2+的鹽溶液。
電極反應(yīng):
陽(yáng)極:
Zn-2e-=Zn2+
Fe-2e-=Fe2+
Ni-2e-=Ni2+
Cu-2e-=Cu2+;
陰極:
Cu2++2e-=Cu。
電冶金
利用電解熔融鹽的方法來(lái)冶煉活潑金屬Na、Ca、Mg、Al等。
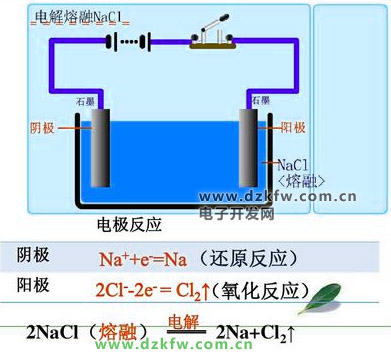
冶煉鈉
2NaCl(熔融)電解2Na+Cl2↑
電極反應(yīng):
陽(yáng)極:
2Cl--2e-=Cl2↑;
陰極:
2Na++2e-=2Na。
冶煉鋁
2Al2O3(熔融)4Al+3O2↑
電極反應(yīng):
陽(yáng)極:6O2--12e-=3O2↑;
陰極:4Al3++12e-=4Al。


 返回頂部
返回頂部 刷新頁(yè)面
刷新頁(yè)面 下到頁(yè)底
下到頁(yè)底