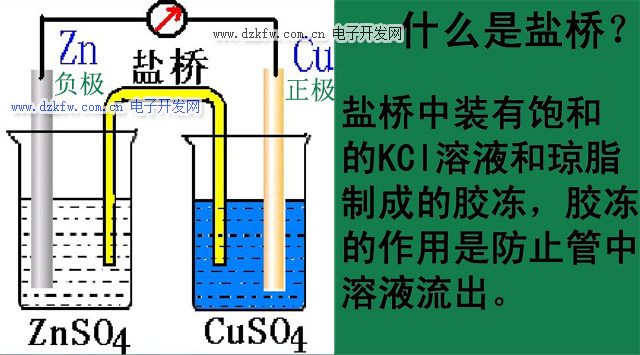
什么是鹽橋,鹽橋作用原理
鹽橋是為了減小液接電位,轉移離子而在兩種溶液之間連接的高濃度電解質溶液。鹽橋常出現在原電池中,是由瓊脂和飽和氯化鉀或飽和硝酸鉀溶液構成的。
鹽橋作用原理
在兩種溶液之間插入鹽橋以代替原來的兩種溶液的直接接觸,減免和穩定液接電位(當組成或活度不同的兩種電解質接觸時,在溶液接界處由于正負離子擴散通過界面的離子遷移速度不同造成正負電荷分離而形成雙電層,這樣產生的電位差稱為液體接界擴散電位,簡稱液接電位),使液接電位減至最小以致接近消除。 防止試液中的有害離子擴散到參比電極的內鹽橋溶液中影響其電極電位。
飽和KCl溶液的濃度高達4.2mol·dm-3,當鹽橋插入到濃度不大的兩電解質溶液之間的界面時,產生了兩個接界面,鹽橋中K+和Cl-向外擴散就成為這兩個接界面上離子擴散的主流。由于K+和Cl-的擴散速率相近,使鹽橋與兩個溶液接觸產生的液接電勢均很小,且兩者方向相反,故相互抵消后降至1~2mV。選擇鹽橋中的電解質的原則是高濃度、正負離子遷移數接近相等,且不與電池中溶液發生化學反應。常采用KCl、NH4NO3和KNO3的飽和溶液。
為什么帶有鹽橋的和不帶有鹽橋的原電池電流持續時比較分析?
帶有鹽橋的和不帶有鹽橋的原電池,帶有鹽橋的持續時間更長:
1、有鹽橋的原電池中鹽橋原電池中,還原劑在負極區,而氧化劑在正極區,化學能轉化成了電能,電流穩定,且持續時間長。
2、而沒有鹽橋的的原電池比有鹽橋的原電池:效率較低,溫度會變,產生的電流較不穩定。因此,沒有鹽橋的的原電池比有鹽橋的原電池:效率較低,溫度會變,產生的電流較不穩定。
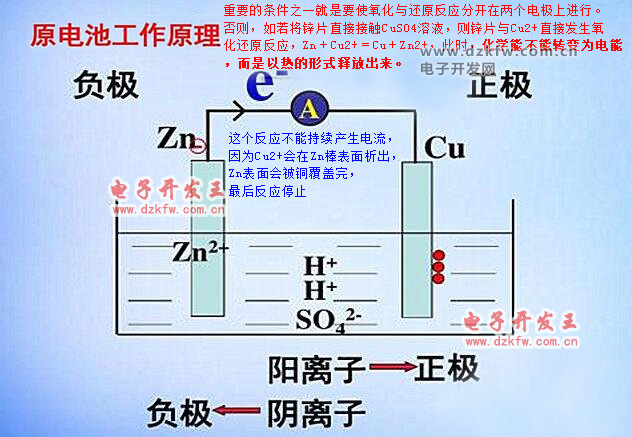
原電池反應屬于放熱的反應,一般是氧化還原反應。
但區別于一般的氧化還原反應的是,電子轉移不是通過氧化劑和還原劑之間的有效碰撞完成的,而是還原劑在負極上失電子發生氧化反應,電子通過外電路輸送到正極上,氧化劑在正極上得電子發生還原反應,從而完成還原劑和氧化劑之間電子的轉移。
兩極之間溶液中離子的定向移動和外部導線中電子的定向移動構成了閉合回路,使兩個電極反應不斷進行,發生有序的電子轉移過程,產生電流,實現化學能向電能的轉化。
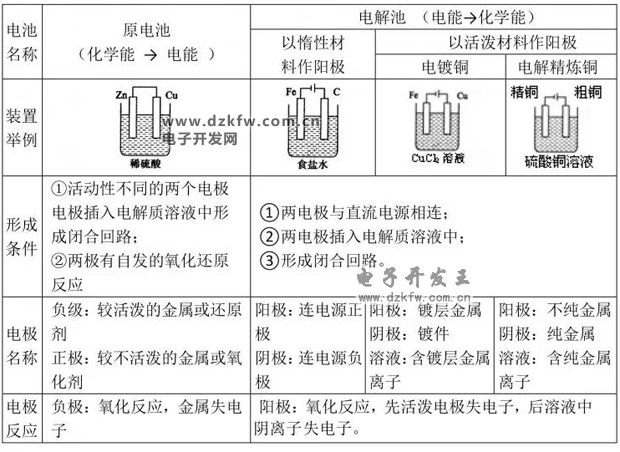
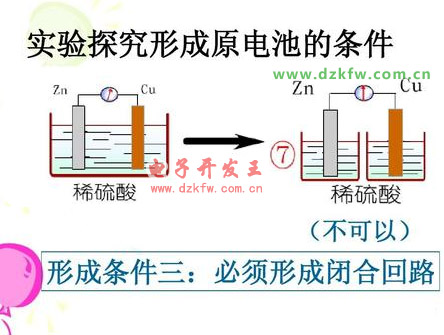
原電池形成條件
1、電極材料由兩種金屬活潑性不同的金屬或由金屬與其他導電的材料(非金屬或某些氧化物等)組成。
2、電解質存在。
3、兩電極之間有導線連接,形成閉合回路。
4、發生的反應是自發的氧化還原反應。
只要具備前三個條件就可構成原電池。而化學電源因為要求可以提供持續而穩定的電流,所以除了必須具備原電池的三個構成條件之外,還要求有自發進行的化學反應。也就是說,化學電源必須是原電池,但原電池不一定都能做化學電池。



 返回頂部
返回頂部 刷新頁面
刷新頁面 下到頁底
下到頁底