燃料電池是原電池中一種比較特殊的電池,它與原電池形成條件有一點相悖,就是不一定兩極是兩根活動性不同的電極,也可以用相同的兩根電極。燃料電池有很多,下面主要介紹幾種常見的燃料電池,希望達到舉一反三的目的。
一、氫氧燃料電池
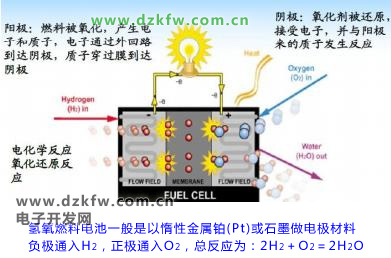
氫氧燃料電池一般是以惰性金屬鉑(Pt)或石墨做電極材料,負極通入H2,正極通入 O2,
總反應為:2H2 + O2 === 2H2O
電極反應特別要注意電解質,有下列三種情況:
1.電解質是KOH溶液(堿性電解質)
負極發生的反應為:H2 + 2e- === 2H+ ,2H+ + 2OH- === 2H2O,所以:
負極的電極反應式為:H2 – 2e- + 2OH- === 2H2O;
正極是O2得到電子,即:O2 + 4e- === 2O2- ,O2- 在堿性條件下不能單獨存在,只能結合H2O生成OH-即:2O2- + 2H2O === 4OH- ,因此,
正極的電極反應式為:O2 + H2O + 4e- === 4OH- 。
2.電解質是H2SO4溶液(酸性電解質)
負極的電極反應式為:H2 +2e- === 2H+
正極是O2得到電子,即:O2 + 4e- === 2O2- ,O2- 在酸性條件下不能單獨存在,只能結合H+生成H2O即:O2- + 2 H+=== H2O,因此
正極的電極反應式為:O2 + 4H+ + 4e- === 2H2O(O2 + 4e- === 2O2- ,2O2- + 4H+ === 2H2O)
3.電解質是NaCl溶液(中性電解質)
負極的電極反應式為:H2 +2e- === 2H+
正極的電極反應式為:O2 + H2O + 4e- === 4OH-
說明:
1.堿性溶液反應物、生成物中均無H+
2.酸性溶液反應物、生成物中均無OH-
3.中性溶液反應物中無H+ 和OH-
4.水溶液中不能出現O2-
二、甲醇燃料電池
甲醇燃料電池以鉑為兩極,用堿或酸作為電解質:
1. 堿性電解質(KOH溶液為例)
總反應式:2CH4O + 3O2 +4KOH === 2K2CO3 + 6H2O
正極的電極反應式為:3O2+12e- + 6H20===12OH-
負極的電極反應式為:CH4O -6e-+8OH- === CO32- + 6H2O
2. 酸性電解質(H2SO4溶液為例)
總反應: 2CH4O + 3O2 === 2CO2 + 4H2O
正極的電極反應式為:3O2+12e-+12H+ === 6H2O
負極的電極反應式為:2CH4O-12e-+2H2O === 12H++ 2CO2
說明:乙醇燃料電池與甲醇燃料電池原理基本相同
三、甲烷燃料電池
甲烷燃料電池以多孔鎳板為兩極,電解質溶液為KOH,生成的CO2還要與KOH反應生成K2CO3,所以總反應為:CH4 + 2KOH+ 2O2 === K2CO3 + 3H2O。
負極發生的反應:CH4 – 8e- + 8OH- ==CO2 + 6H2O CO2 + 2OH- == CO32- + H2O,所以:
負極的電極反應式為:CH4 + 10 OH- + 8e- === CO32- + 7H2O
正極發生的反應有:O2 + 4e- === 2O2- 和O2- + H2O === 2OH- 所以:
正極的電極反應式為:O2 + 2H2O + 4e- === 4OH-
說明:掌握了甲烷燃料電池的電極反應式,就掌握了其它氣態烴燃料電池的電極反應式
四、鋁–空氣–海水電池
我國首創以鋁–空氣–海水電池作為能源的新型海水標志燈,以海水為電解質,靠空氣中的氧氣使鋁不斷被氧化而產生電流。只要把燈放入海水中數分鐘,就會發出耀眼的白光。
電源負極材料為:鋁;電源正極材料為:石墨、鉑網等能導電的惰性材料。
負極的電極反應式為:4Al-12e-===4Al3+;
正極的電極反應式為:3O2+6H2O+12e-===12OH-
總反應式為:4Al+3O2+6H2O===4Al(OH)3
說明:鋁板要及時更換, 鉑做成網狀是為了增大與氧氣的接觸面積.



 返回頂部
返回頂部 刷新頁面
刷新頁面 下到頁底
下到頁底