本文通過簡要介紹常見的熱能轉換裝置的工作過程,建立工質、熱力系統、熱力狀態(tài)、狀態(tài)參數、可逆過程、循環(huán)等概念,使我們能正確理解這些基本概念的定義和意義。
常見熱能轉換裝置的工作過程:1、柴油機工作過程
柴油機是活塞式內燃機的一種,它的基本結構由固定部件、運動部件、配氣系統、燃油系統、潤滑系統、冷卻系統、操縱系統組成,圖1是四沖程柴油機工作原理示意圖。
柴油以霧狀噴入氣缸,在氣缸中與高溫高壓的空氣混合并燃燒,燃燒后的高溫高壓燃氣推動活塞下行并帶動曲軸轉動。燃料的化學能通過燃燒轉化為熱能,又通過曲柄連桿機構轉化為輸出的機械能,通過進、排氣過程完成新鮮空氣與廢氣的置換。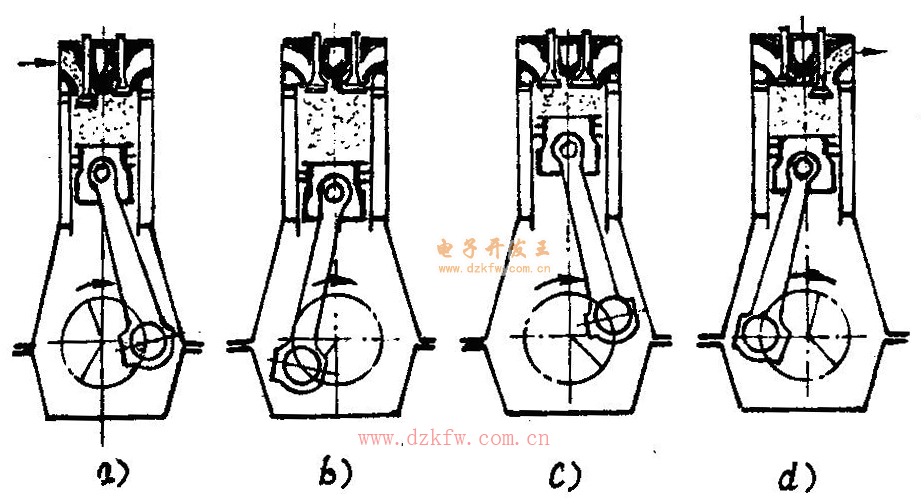
圖1四沖程柴油機工作原理示意圖
1)燃氣輪機裝置工作過程
簡單的燃氣輪機裝置包括壓氣機、燃氣輪機、燃油泵和燃燒室。圖2是燃氣輪機裝置的示意圖。油泵和壓氣機向燃燒室供給增壓后的燃油和空氣,它們在其中混合并燃燒,釋放出熱能,燃燒后的高溫燃氣在葉輪前的噴管中膨脹,把熱能轉換成動能,高溫燃氣轉變成高速氣流,高速氣流沖擊葉輪葉片,并使葉輪輪軸轉動,向外輸出機械能,作功后的廢氣由排氣口排向大氣并在大氣中放熱。
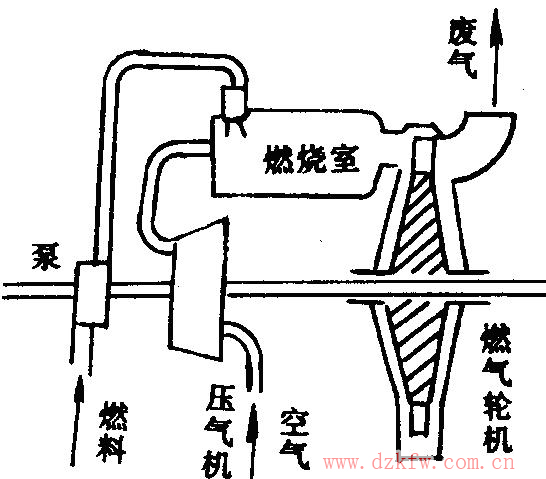
圖2燃氣輪機裝置示意圖
2)、蒸汽動力裝置工作過程
蒸汽動力裝置由鍋爐、蒸汽輪機、冷凝器、水泵所組成,燃料在鍋爐的爐膛內燃燒,將燃料的化學能轉變成煙氣的熱能,經爐膛沸水管壁傳熱給管內的水,水受熱后變成蒸汽儲藏在汽包內,包內的蒸汽又通過過熱器進一步加熱后,輸送到汽輪機,蒸汽進入汽輪機后,先在汽輪機進口處的噴管中膨脹,轉變成高速氣流,高速氣流沖擊汽輪機葉片,并使汽輪機輪軸轉動,向外輸出機械能。作功后的乏汽排入冷凝器,在冷凝器中放熱并冷凝成水,水再由水泵送入鍋爐,經加熱后又變成蒸汽。如此循環(huán)往復,蒸汽動力裝置就不斷地將熱能轉換成機械能并傳輸給外界。
3)、蒸汽壓縮制冷裝置的工作過程
產生并保持比環(huán)境溫度低的溫度需要制冷裝置。在船上及生活等領域普遍采用蒸汽壓縮制冷裝置。蒸汽壓縮制冷裝置的基本設備由壓縮機、冷凝器、熱力膨脹閥、蒸發(fā)器(冷庫)所組成,圖4為它的示意圖。
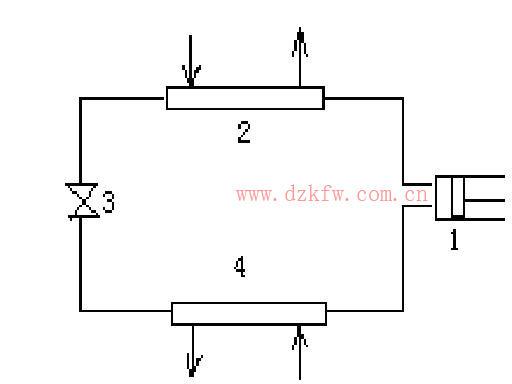
圖4 蒸汽壓縮制冷裝置工作示意圖
從對上述四個熱能轉換裝置工作過程的介紹可以看出,柴油機、燃氣動力裝置、蒸汽動力裝置雖然它們的工作原理、設備各不相同,但都是將熱能轉變成機械能的裝置,這也是一切熱動力機能量轉換的共同方式;而蒸汽壓縮制冷裝置則是用消耗機械能的方式將低溫制冷劑升高溫度,使從冷庫中取出的低溫熱量和消耗的壓縮功一起放給環(huán)境。消耗一定的能量才能使低溫熱量傳向高溫環(huán)境,這也是一切制冷裝置的工作原理。
2、工質
從上述熱力設備的工作過程中我們知道,在熱能和機械能的相互轉換中必須要有一個工作物質,例如柴油機的工作物質為空氣和燃氣,蒸汽動力裝置的工質為水和水蒸汽,蒸汽壓縮制冷裝置的工作物質為制冷劑。在熱力轉換過程中由這個工作物質來吸收熱量膨脹并對外做功,或者由這個工作物質把從冷庫吸收的熱量放給環(huán)境,沒有這個工作物質,就不可能實現熱能和機械能之間的轉換。我們把這個工作物質稱為工質,即實現熱能和機械能相互轉換的媒介物稱為工質。
作為工質的物質必須具有良好的膨脹性、壓縮性和流動性。所以,熱動力裝置所用的工質都為氣態(tài)物質,如空氣、燃氣和蒸汽。
1)熱力學系統
從上述熱能轉換裝置的工作過程我們知道,任何一種能量轉換裝置都是由幾個相互作用的實現能量轉換或傳遞的熱力設備所組成的。例如蒸汽動力裝置是由鍋爐、蒸汽輪機、冷凝器、水泵所組成。為了進行熱力學分析,首先我們要在相互作用的各種熱力設備中劃分一個(或幾個)熱力設備作為研究對象,這種被劃分出來的研究對象稱為熱力學系統,簡稱系統。系統之外的其它熱力設備統稱為外界。系統與外界的分接口稱為邊界。邊界可以是真實的,也可以是設想的。例如取壓縮空氣瓶內的空氣為系統,則瓶的內壁面就是真實的邊界;而當取廢氣渦輪內的空氣作為系統時,則進出口處的邊界是設想的。
熱力學系統與外界一般有三種相互作用:系統與外界的物質交換,熱的交換和功的交換。按照系統與外界相互作用的特點,在熱力學中往往把系統分為下述幾類。
閉口(封閉)系統:系統與外界沒有物質的交換。例如把柴油機氣缸中正進行膨脹的燃氣選作系統,盡管燃氣會從氣缸與活塞的縫隙間漏泄一點,但泄漏量極小,可以足夠精確地看作系統與外界沒有物質交換,這就是封閉系統,如圖5所示。封閉系統是由閉合表面包圍的質量恒定的物質集合。封閉系統與外界可以有熱和功的交換,也可以沒有。
開口系統:系統與外界有物質的交換。例如把廢氣渦輪選作系統,它有工質的流入與流出,這就是開口系統,如圖6所示。開口系統與外界可以有熱和功的交換,也可以沒有。
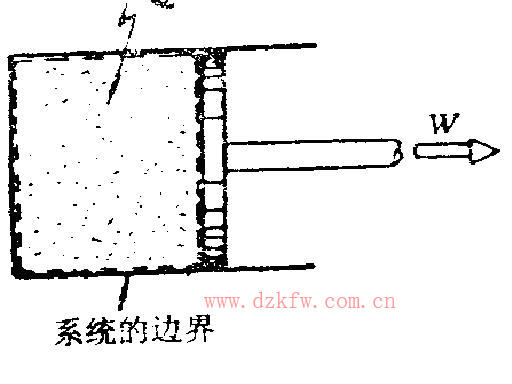
圖5封閉系統
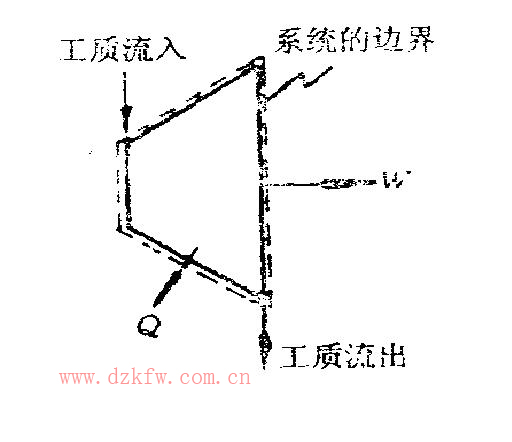
圖6 開口系統
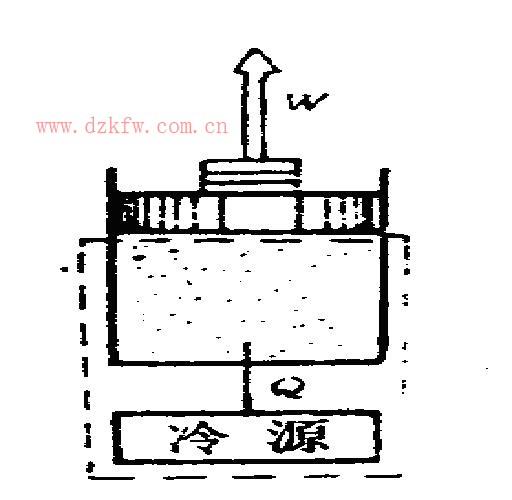
圖7 絕熱系統
絕熱系統:系統與外界沒有熱量的交換。如圖7所示的燃氣膨脹時有熱量傳給冷卻水,如取燃氣和冷卻水(通常稱為冷源)為系統,則包括燃氣和冷卻水的系統與外界沒有熱交換,因而該系統為絕熱系統。
孤立系統:系統與外界沒有物質交換,也沒有熱和功的交換。如果把所有發(fā)生相互作用的各種熱力設備作為一個整體,并把這個整體選定為所研究的系統,雖然這個系統內部的各部分可以有物質交換、熱和功的交換,但這個系統作為整體與外界沒有任何相互作用,那么這個系統就是孤立系統。
與系統發(fā)生作用的外界也可分為以下幾種:
熱源:熱力學中將與系統只發(fā)生熱的相互作用的外界,稱為“熱源”。溫度高的熱源稱為高溫熱源,溫度低的熱源稱為低溫熱源,并且認為熱源的容量足夠大,它吸入和放出有限熱量時溫度保持不變。
功源:熱力學中將與系統只發(fā)生功的相互作用的外界定義為“功源”。功源與封閉系統交換的功是直接通過系統中工質膨脹或壓縮引起的容積改變實現的,稱為“容積功”;功源與開口系統交換的功通過轉軸傳遞,稱為“軸功”。習慣上,系統對外界(功源)作功為正值,外界(功源)對系統作功為負值。
質源:熱力學中將與系統進行物質交換的外界定義為“質源”
2)熱力系統的狀態(tài)參數
從上面的討論可以知道,當系統處于平衡狀態(tài)時,可以用確定的唯一的一組狀態(tài)參數值來描述它。在工程熱力學里,常用的狀態(tài)參數有六個,即壓力、溫度、容積、內能、焓和熵。在這六個狀態(tài)參數中,只需知道其中任意兩個獨立的狀態(tài)參數就可以決定一個狀態(tài),所以工質的狀態(tài)也可以用參數坐標圖表示。
工程上把可直接觀察和測量的狀態(tài)參數稱為基本狀態(tài)參數,它們是壓力、溫度和比容。
在工程熱力學中,把工質指向系統表面(真實的容器壁或假想的分接口)單位面積上的垂直作用力,稱為“壓力”(即壓強)。分子運動論把氣體壓力看作是氣體分子撞擊壁面的宏觀表現,數值上等于單位容積內的分子數與分子的平均移動動能乘積的三分之二。
壓力的定義式:![]()
上式中:P------工質指向表面的垂直作用力,單位為牛頓,用N表示;
f-------作用面積,單位為平方米,用m2表示。
壓力的國際單位為N/m2,稱為帕斯卡,簡稱“帕”,符號為Pa。
系統的真實壓力稱為絕對壓力,絕對壓力p是工質的狀態(tài)參數。因為不管用什么測壓儀表,如圖8彈簧管壓力表、圖9U形管壓力計,測得的是工質的絕對壓力p與大氣壓力pb之間的相對值。因為大氣壓力隨時隨地都會發(fā)生變化,所以測量值不等于系統的真實壓力值,不能真實地表示系統內工質所處的熱力狀態(tài),所以這個相對值就不是工質的狀態(tài)參數
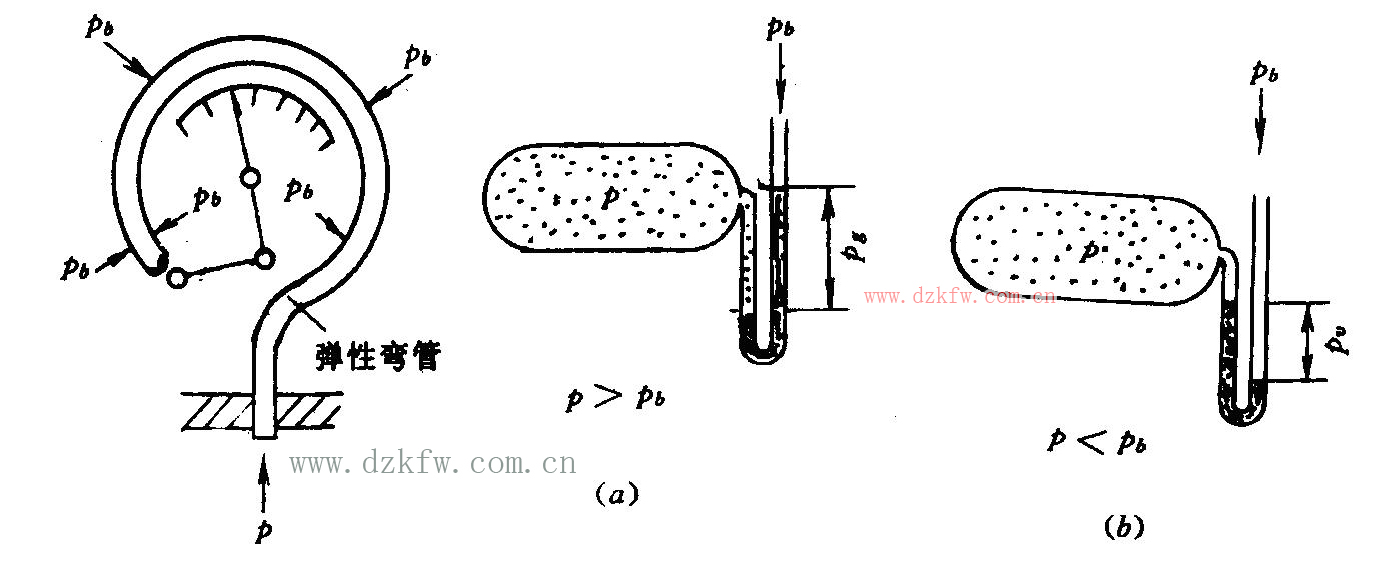
圖8 彈簧管壓力表 圖9 U形管壓力計
當絕對壓力高于大氣壓力(p> pb)時,壓力表(計)指示的數值稱為表壓力,用pg表示,如圖9(a)所示。顯然,這時系統絕對壓力為: 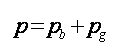
當絕對壓力低于大氣壓力(p< pb)時,壓力表(計)指示的讀數稱為真空度,用pv表示,如圖9(b)所示。顯然,這時系統的絕對壓力為: ![]()
3)、溫度
從熱力學的角度來看,處于熱平衡的各個系統,必定有某一宏觀特性是彼此相同的,描述此宏觀特性的物理量稱為溫度。
從宏觀上來看,溫度是表示工質冷熱程度的量度,溫度是判斷工質能否從外界接受熱量,或者對外傳出熱量的根據。
溫度的數值表示方法稱為溫標,常用的溫標有以下三種:
攝氏溫標:即在標準大氣壓力下,純水的冰點規(guī)定為0度,沸點為100度,在這兩點之間均分為100等分,取其中的一份為攝氏1度,記作:1℃,攝氏溫標用符號t℃表示。
華氏溫標:即在標準大氣壓力下,純水的冰點規(guī)定為32度,沸點為212度,在這兩點之間均分為180等分,取其中的一份為華氏1度,記作:1oF,華氏溫標用符號toF表示。
熱力學溫標:又稱絕對溫標,它是以攝氏零下273.15度作為絕對溫標的零度,每度的間隔與攝氏溫標相同,1度記作1K,開氏溫標用符號TK表示。
大部分國家應用攝氏溫標,英、美等國家采用華氏溫標,工程熱力學計算中常用絕對溫標,因此必須掌握它們之間的換算。
根據上述三種溫標的定義,如果已知攝氏溫度為t℃,則相當于華氏溫度為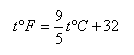
若已知華氏溫度為toF,則相當于攝氏溫度為 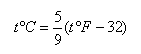
若已知攝氏溫度為t℃,則絕對溫度為 ![]()
4)、容積和比容
一定質量的工質所占有的空間稱為工質的容積,用V表示,單位是m3。單位質量工質的容積稱為比容,用符號v表示,單位為m3/kg。設質量為m kg的工質所占的容積為V m3,則其比容為:
v=V/m m3/kg。
容積和比容均為工質的熱力狀態(tài)參數。
5)、內能和比內能
物質內部具有各種能量,如由原子結合成分子的化學能、原子內部的原子能以及分子不規(guī)則運動的熱能。工程熱力學研究的是熱能與機械能之間的相互轉換,因此把工質具有的熱能稱為內能。用U表示,單位是KJ。單位質量工質的內能稱為比內能,用u表示,單位為KJ/kg。可見 u=U/ m
6)、焓和比焓
因為工質流經開口系統時其比內能u和壓力與比容的乘積pv總是同時出現,所以在熱力學中把這兩者之和稱這比焓,用h表示,單位是KJ/kg。即 ![]()
對于mkg處于平衡狀態(tài)的工質,則有
![]()
式中的H稱為mkg工質的焓,單位為KJ。
因為U、u、p和v均為工質的狀態(tài)參數,因此焓和比焓也為工質的熱力狀態(tài)參數。
7)、熵和比熵
在一個微元過程中,mkg工質從熱源吸收的微元熱量dQ除以工質吸熱時的絕對溫度T所得的商,定義為工質在絕對溫度T時熵S的增量dS, ![]() 即 將上式兩邊除以m,得
即 將上式兩邊除以m,得![]()
熵S的單位為KJ/k,s為工質的比熵,單位是KJ/kg.k。熵和比熵均為工質的熱力狀態(tài)參數。
由以上兩式可知,dq>0,則ds>0,即系統從熱源吸熱,工質比熵增加;反之,dq<0,則ds<0,即系統向熱源放熱,工質比熵減少;若dq=0,則ds=0,即系統與熱源絕熱,工質比熵不變。因此我們可以根據工質比熵的變化來判斷系統與外界熱傳遞的方向。
對內能U或比內能u、焓H或比焓h、熵S或比熵s,在熱力學的計算中只用到它們的變化量,因此它們?yōu)榱阒档幕鶞蕬B(tài)可以人為地選定。


 返回頂部
返回頂部 刷新頁面
刷新頁面 下到頁底
下到頁底